无法预知未来,但可预测未来。
2020年2月12-15日,一年一度的欧洲克罗恩病和结肠炎组织年会(ECCO 2020)在维也纳隆重举行。ECCO是世界领先的炎症性肠病(IBD)学术盛会,然而我国医生受疫情影响未能现场参与此次会议。为此,武田制药公司携手全国IBD诊治中心和专家,以网络会议的形式结合各个IBD中心的临床经验,为大家伙儿一起来分享ECCO会议的最新研究进展。
本期特别邀请到山东大学齐鲁医院消化病研究所所长李延青教授,消化科主任医师左秀丽教授和杨晓云教授,几位专家从IBD结局预测方面分享了此次ECCO会议的重点内容。
图1:专家介绍
如何预测IBD致残?
首先,左秀丽教授从IBD病程发展和结局预测的角度为大家伙儿一起来分享了此次ECCO会议的相关研究进展。
图2:CD自然病史
一项为期240月的克罗恩病(CD)患者随访研究表明,IBD患者的病程发展是从炎性病变开始,最终以出现狭窄、瘘管、脓肿等并发症为结局。因此左秀丽教授特别指出,需要着重关注的是在治疗过程中广大医生需要抓住哪些治疗窗,以降低致残率、改善患者生活品质[1]。
残疾被定义为由于损害导致以人们认为正常的方式或范围进行活动的能力受到任何限制或缺乏。残疾与间接或直接降低收入有关,也与减少受教育机会有关。除了CD患者外,溃疡性结肠炎(UC)的患者致残率也很高。这大幅度提升了IBD的疾病负担[2]。
那么通过及早识别疾病、及早进行鉴别诊断和治疗可以有效的预防残疾吗?左秀丽教授表示,可以。WHO进行了10年的国际合作项目,制定并验证了炎症性肠病致残指数(IBD-DI)。在未来的临床研究中应把IBD-DI作为研究的主要/次要终点, 并对根据疾病严重程度对患者进行分层,以便于观察临床研究中的干预措施是否可以有效的预防IBD疾病致残性发生[2]。
最新开发的IBD-Disk是IBD-DI的缩减版本,有可能成为在常规临床就诊期间使用的有价值的工具,并且能够准确地捕获与残疾相关的特定问题,并将残疾随时间的变化关联起来。此外,识别早期疾病及早期用药改变自然病史,以避免疾病并发症、防止残疾的概念正在引起人们的关注。例如有研究证实,在CD疾病早期使用生物制剂会更有效,原因可能是由于疾病早期和中后期的炎症负担与细胞因子类型不同[2]。
个体风险可视化评估
有研究指出,在中国,最常见的致残事件包括新发肛周痿/脓肿(38.1%)、新发肠道狭窄(27.6%)和手术(24.8%)。其中,手术(35%)和新的肠道狭窄(35%)是复发性致残性疾病的主要事件[3]。研究发现,在致残疾病发生前已获得黏膜愈合(MH)的患者,之后均未发生致残性疾病的复发;而没有在残疾疾病发生前获得MH的患者中,20.8%发生了致残性疾病的复发。多因素分析均表明,MH是致残性疾病发生的独立保护因素与减少IBD致残率相关[3]。
图3:PROSPECT输入界面
IBD作为一种异质性、发病机制不明且疾病行为很复杂的疾病,更需要根据病人的临床和生物学特征制定最优的诊疗方案,即实现最佳个体化诊疗。也因此更需要一个整合多重组学分析和标准化临床数据的技术平台。PROSPECT就是这样一个技术平台。它是根据人口学、临床特征、血清学免疫反应、NOD2基因、并发症、诊断时间、药物暴露信息进行比例分析建立CD并发症随时间发展的概览模型。是一个有效的、个性化的、基于网络的工具,并可以将预测三年内CD并发症的风险可视化[4]。
左秀丽教授认为,未来IBD治疗需要努力的方向是在早期亚临床炎症阶段通过多组学分析、内镜检测、网络大数据技术评估等手段识别患者,从而通过早期干预实现结局改善,减少致残率,提高患者的生活品质。
预测传统药物的疗效与应答
随后,杨晓云教授为大家从预测传统药物和生物制剂的应答以及合理使用的角度分享了精彩观点与个人思考。
IBD治疗手段不断进展,但激素仍然是治疗活动性IBD的常用药物。然而病程长的患者长时间反复使用激素,容易导致激素耐受;老年发病的UC患者激素治疗的预后较差,具有较高的手术率、发作次数和住院率,相当一部分患者对激素不耐受,所以激素合理使用被广大医生着重关注。
活动性UC患者中,基于短期激素应答的UC患者的长期结果和自然病程是未知的。因而基于这样的一个问题,一篇前瞻性观察性研究指出,激素第30天的短期应答是第1年和第3年长期病程的有力预测指标[5]。对于急性重症UC患者,ECCO提倡应该在入院时或最晚在静脉激素治疗第3天,评估IBD重度结肠炎的危险分层,识别激素抵抗高风险的患者并尽早采取升级治疗或手术治疗[6]。
预测生物制剂的疗效与应答
近年来,生物制剂开始应用于IBD治疗,大致上可以分为抗TNF、抗整合素和抗白介素制剂三大类。其中,抗整合素制剂维得利珠单抗是目前中国获批的唯一肠道选择性生物制剂,通过结合T淋巴细胞表面的整合素抑制T淋巴细胞迁移从而减少肠道黏膜炎症,为IBD患者提供了精准肠道选择的全新治疗方案。
对于抗TNF治疗疗效的预测,一篇2012年的研究对纳入的使用抗TNF治疗的UC患者进行了全血细胞计数和生化血液检查发现:5个生物学变量C反应蛋白(CRP)≦1.5mg/L、白蛋白>39.2g/L、铁蛋白>23.3mg/L、血小板≦302g/L和血红蛋白>12.9g/dL与临床缓解独立相关。其中血小板≦302g/L和白蛋白>39.2g/L的多变量模型在预测临床缓解方面表现最佳[7]。
另外杨教授指出,许多患者对抗TNF药物不应答或失应答,因此预测应答将是极为有价值的临床工具。一篇2019年的研究发现7种细胞因子TNF-a、IL-12、IL-8、IL-2、IL-5、IL-1β和IFN-γ可以预测UC患者对抗TNF制剂的应答,敏感性为84.2%,特异性为93.3%。细胞因子简单、便宜而且可定量,所以该模型可能是一种有临床价值的新工具[8]。
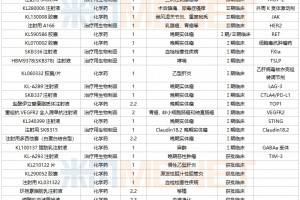
图4:联合终点预测52周生物制剂治疗后临床缓解
而在使用生物制剂并在“达标治疗”和“严密控制”策略下,单独用患者症状、CDAI、CRP和Fcal监测CD患者疾病活动效果仍不理想。所以一篇研究指出联合终点[克罗恩病活动指数(CDAI)
杨晓云教授指出,IBD治疗进入生物制剂时代,治疗目标已经从控制症状变为达标治疗。然而仍有患者对生物制剂原发性失应答,或存在继发性失应答。即便早期使用生物制剂,UC和CD中仍然有患者最终无法逃避接受肠切除手术的结局。因此,临床实践中需要着重关注如何合理使用生物制剂、有效并科学监测药物浓度和抗体水平实现疗效监测和复发预测。
临床解答
会议最后,李延青教授主持了问答与讨论环节,左秀丽教授与杨晓云教授解答了现场医生关于预测早期IBD患者、生物制剂失应答等疑问。
左秀丽教授认为,临床伺机筛查对于IBD病人是很有必要的。对于疑似肠易激综合征、阑尾炎、右下腹痛、慢性腹泻、不明原因长期关节皮肤病损患者,医生可根据临床经验判断是否有必要做生物标志物、内镜、影像学筛查。前期诊断患者要密切随访,早期干预以防止后期并发症及不良结局。
杨晓云教授表示,生物制剂治疗效果不佳需要仔细考虑原因。若是原发性失应答可考虑换药物成分;若是继发性失应答,需要分析剂量、疗程以及是否合并炎症感染,排除因素后再决定转换治疗或手术治疗。对于重症UC患者,约1/3会伴随CMV感染,可以活检染色查巨细胞、监测CMV DNA。治疗方面需要先用抗病毒药物,但考虑副作用,紧密筛查。
本次网络会议上,齐鲁医院的消化专家们总结了ECCO会议的精彩内容,并结合个人临床经验从适合中国病情的角度为大家带来了不一样的见解。会议现场学术气氛热烈,参会者可谓满载而归。敬请期待我们之后的精彩网络会议内容。
团队简介
山东齐鲁医院IBD中心团队
山东省唯一一家“炎症性肠病诊疗区域中心”
齐鲁医院消化内科于2019年10月25日顺利通过炎症性肠病区域诊疗中心评审会评审,成为全国首批39家区域中心的一员,也是山东省唯一一家获得“炎症性肠病诊疗区域中心”。
齐鲁医院IBD-MDT涵盖消化内科、病理科、影像科、胃肠外科、风湿科、营养科、肿瘤科、心内科、血液科等20多个临床科室及专业的IBD护理团队,充分整合了各科资源与优势。
中心制定了严格的标准化操作规程,开设IBD专病门诊,设立专科病房并配备固定的专病病床和护士。与此同时,中心组织专人建立IBD诊疗中心病例数据库,为我院在该领域的科研工作奠定良好基础。近三年消化内科获IBD有关的省部级以上科研项目3项,并主持开展山东省IBD多中心临床研究,参与了多项IBD相关的全国多中心临床研究,发表数篇高影响因子SCI论文,在该领域培养了多名优秀的博、硕士研究生。
齐鲁医院消化内科在全国消化领域具有较高的声誉。在学科带头人李延青教授和科室负责人左秀丽主任的带领下,率先在山东省内建立了“山东省炎症性肠病健康医疗大数据科学技术创新平台”,并在山东省内各地开展IBD诊治规范巡讲工作。团队致力于引领山东省IBD临床诊疗和科学研究相关工作,在IBD规范化诊治、基础和临床研究等方面,得到了全国同行和患者的高度认可。
Zinc号:CN/ENTCD/2004/0058
声明:本内容仅针对中国医疗卫生专业技术人员,旨在向且仅向医疗卫生专业技术人员提供科学信息,用于个人学习和参考之用。如果您不是医疗卫生专业技术人员,请勿参与或传播。
参考文献:
1. Peyrin-Biroulet L, et al. Am J Gastroenterol. 2010 ;105(2):289-97.
2. Allen PB, et al. Therap Adv Gastroenterol. 2017;10(11):865-76.
3. Huang S, et al. Clin Transl Gastroenterol. 2019;10(3):e00015.
4. Siegel CA, et al. Aliment Pharmacol Ther. 2016;43(2):262-71.
5. Rai T, et al. Dig Dis Sci. 2017;62(4):1025-34.
6. C Jemmali, et al. J Crohns Colitis. ECCO 2020 P593.
7. A Oussalah, et al. J Crohns Colitis. ECCO 2012 P197.
8. Obraztsov IV, et al. Inflamm Bowel Dis. 2019;25(3):524-31.
9. Sollelis E, et al. World J Gastroenterol. 2019;25(19):2354-64.
- End -