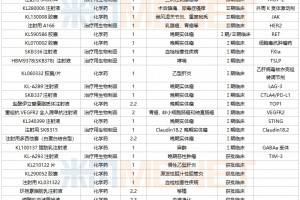
原标题:生物兼容性测试咨询
为了确保医疗设备的生物兼容性,根据ISO 10993-1 – 全球第一套评估医疗设备生物兼容性的国际标准和FDA blue book memorandum (#G95-1),中提出了几项帮助医疗设备制造商选择材料的试验。 所有医疗设备均须通过细胞毒性、刺激和过敏三项测试。
2)上述路径存在差异,可以通过是否有差异性的风险分析报告、文献和标准→是否有差异性的材料的生物相容性报告→是否和其他助剂发生反应→是否和产品的接触剂量(残留)和接触途径一致→形成生物相容性评价报告→结束评价
·基于器械与身体接触特点与期限分类3.的类别描述;
其二,给医疗器械一张“身份证”,杜绝高风险、二手器械。
背景:在近的483中,我们发现传统上并不认为是GMP记录的文件(例如,电子邮件和其它通讯信息)成为了监督和缺陷的对象。官方目前将何种文件视为GMP记录(如电子邮件、主管日程等)如果有一个工作定义,将对会企业大有帮助。为了便于运营,公司会持续沟通关于生产和质量活动的讯息。一份关于批放行的电子邮件可能基本上等同于一位同事向另一位同事说明一个批次已放行的书面形式。要求正式控制所有这些文件,或要求此类文件不能任意打印出来和丢弃/销毁/碎掉,会对公司及其质量部门造成很大负担。

药监机构的数据完整性检查缺陷在法规和公众观念方面可能会有很严重的影响,不应该是由于企业缺乏对所需工作的了解而造成。另外,在检查期间,企业没有能力生成所需记录或文件会受到关切,即使不是标准报告或现存质量体系文件,这可能会构成拖延、否决、限制或拒绝检查,这也会产生严重后果。
植入性测试,通常使用兔子。考虑2-12周的短周期,或大于12周的长周期测试。
在审查成本允许、合理的条件下,加强对医疗器械的审查及安全性评估是降低风险的有效措施。吻合器此前被FDA归为第一类医疗器械,正是宽松的审查制度导致质量参差不齐的吻合器进入市场。
企业应从申请的目的出发,有针对性地申请。为了获取*的利益,可以从本企业产品的角度提前进行布局;对于竞争企业,应该以长远的目光去看待,预测“竞争对手”产品的成长路线,提前在市场做出布局,将更多的机会把握在自己手中。
确认将试验样品浸提液与试验系统接触,被认为是优秀接触方式。

责任编辑: